http://dx.doi.org/10.15741/revbio.03.02.04
Navarro-Rodríguez, M.C.1*, Flores-Vargas, R2, González Guevara, L.F.1.
Universidad de Guadalajara, Centro Universitario de la Costa, 1Campus Vallarta Departamento de
Ciencias Biológicas (UDG-CA-345) Av. Universidad, No. 203, Delegación Ixtapa Puerto Vallarta Jalisco, México.
2Departamento de Estudios para el Desarrollo Sustentable de Zonas Costeras (UDG-CA-341),
Gómez Farías No. 82, San Patricio Melaque Jalisco, México.
*Corresponding Author:
Navarro Rodríguez, M.C., Av. Universidad, No. 203, C.P. 48282, Delegación Ixtapa Puerto Vallarta Jalisco. México. Phone: +52(322) 2262 335. E-mail.: carmennavarro28@yahoo.com.mx
Información del artículo / Article Info
Revista Bio Ciencias 3(4): 103-115
Received/Recibido: August 10th 2014
Accepted/Aceptado: October 10th 2014
Cite this paper/Como citar este artículo: Navarro-Rodríguez, M.C., Flores-Vargas, R, González Guevara, L.F.1. (2015). Seasonal variation of the main zooplanktonic groups of the protected natural area estuary el Salado, Jalisco, Mexico (Spring-winter 2001). Revista Bio Ciencias 3(2): 103-115.
http://editorial.uan.edu.mx/BIOCIENCIAS/article/view/170/156
|
PALABRAS CLAVE |
KEY WORDS |
||
Estero, zooplancton, abundancia, parámetros físico--químicos |
Estuary, zooplankton, abundance, physical-chemical parameters |
||
RESUMEN |
ABSTRACT |
||
Los sistemas estuarinos son los recursos naturales acuáticos más importantes de la nación desde varias perspectivas principalmente la del aprovechamiento pesquero, que a través de estudios permiten la detección y evaluación de las áreas de concentración de los adultos en reproducción y las especies potencialmente explotables. El presente trabajo analiza la variación estacional de la abundancia de los grupos zooplanctónicos presentes en el Estero El Salado, Puerto Vallarta, Jalisco. Se realizaron ocho arrastres zooplanctónicos en periodos diurnos de primavera a invierno del 2001, los arrastres fueron superficiales con una duración de diez minutos, mediante el empleo de una red tipo “Zeppelín” con luz de malla de 505 µm con una longitud de 1.50 m y diámetro de boca de 0.60 m, la cual fue equipada con un flujómetro digital para calcular el volumen de agua filtrada, los datos de abundancia fueron normalizados a un volumen de 1000 m3. La captura total fue de 101,968.4 organismos, representados en once grupos, siendo los braquiuros el grupo más importante de acuerdo al orden de abundancia representando el 44.5 %, seguido de los quetognatos con el 24.1 %, los decápodos con el 6.78 %, eufáusidos con el 11.84 %, y con menores abundancias los copépodos con un 6.18 %, sifonóforos pequeñas medusas 3.37 %, estomatópodos 2.83 %, anfípodos 0.22 %, cladóceros con 0.33 %, gasterópodos con el 0.08 % y finalmente los organismos muy poco frecuentes con el 0.02 % (apendiculados, poliquetos y cumaceos). Las variaciones en la abundancia tanto espacial como temporal estuvieron influenciadas por las condiciones de mareas así como por las variaciones de la temperatura y la salinidad. Las abundancias registradas de los principales grupos zooplanctónicos, fueron homogéneas en los cuatro periodos estacionales; sin embargo la primavera se caracterizó por presentar poca abundancia, en tanto que para el verano e invierno se registraron los valores más altos, representados principalmente por los braquiuros, y cuyas abundancias estuvieron asociadas con dos periodos de reproducción en ambas épocas del año. |
Estuarine systems are the most important aquatic natural resources of the nation from various perspectives; fisheries use them mainly through studies that allow the detection and evaluation of the areas of concentration of adults on reproduction phase and potentially exploitable species. This present paper analyzes the spatial and temporal variation of the abundance of zooplankton groups in the Estuary El Salado, Puerto Vallarta, Jalisco. Eight zooplanktonic trawls were conducted during diurnal periods from spring to winter 2001, trawls were superficial, lasting ten minutes, by using a standard “Zeppelin” net with a mesh size of 505 µm with a length of 1.50 m mouth width of 0.60 m which was equipped with a digital flow meter to calculate the volume of filtered water, abundance data were normalized to a volume of 1000 m3. The total catch was 101,968.4 organisms, represented in eleven groups, the brachyurans were the most important group in the order of abundance accounting for 44.5 %, followed by 24.1 % in chaetognaths, decapod with 6.78 %, euphausiids with 11.84 %, and less abundant copepods with 6.18 %, 3.37 % siphonophores small jellyfish, stomatopods 2.83 %, 0.22 % amphipods, cladocerans with 0.33 %, 0.08 % gastropods and finally rare organisms with 0.02 % (appendicular, polychaetes and cumaceans). Variations in both spatial and temporal abundance were influenced by tidal conditions as well as variations in temperature and salinity. All registered major zooplankton groups abundances were homogeneous in the four seasonal periods, however spring was characterized by low abundance, while for summer and winter, the highest values recorded were represented mainly by the Brachyura order, and those abundances were associated with two reproductive periods in both seasons. |
||
Introducción |
Introduction |
||
La biomasa zooplanctónica ha sido ampliamente reconocida como un importante indicador para estimar la variabilidad de la producción secundaria (Kane, 1993), por lo que es el principal componente en la trama alimentaria acuática, puesto que conforma un conjunto heterogéneo que incluye una gran variedad de taxones de diversos tamaños, formas y composición química (Cifuentes et al., 1997). Se describe como un componente de suma importancia en la transferencia de energía en los niveles tróficos en los sistemas pelágicos, es decir, sirve de eslabón entre los productores primarios y productores secundarios (Heinrich, 1962; Shernana et al., 1983; Álvarez-Silva et al., 2006). Mullin et al., (1997) señala que entre el zooplancton en general y el ictioplancton se establecen relaciones alimentarias recíprocas que presentan una enorme importancia, puesto que llegan a intervenir en algunas ocasiones y de forma decisiva en la regulación de los tamaños de los stocks de algunas especies de peces, debido a que la disponibilidad del microzooplancton es determinante en la tasa de sobrevivencia de las larvas de peces en los océanos, considerándose como un buen indicador de la disponibilidad de alimento (Sánchez Ramírez, 1997). Una característica sumamente importante que interviene en los patrones de distribución y abundancia de la biomasa, es la condición física y dinámica de las masas de agua en las que se encuentran y que a la vez permite la adaptación de varios taxas animales a intervalos relativamente estrechos de temperatura y salinidad (Sábates et al., 1989). En otro sentido, esta distribución está controlada tanto por conducta activa como por mecanismos de transporte pasivo y por algunos de los factores físicos, donde se incluyen tanto eventos hidrográficos como corrientes oceánicas y costeras, así como frentes, surgencias, vientos, estratificación de la columna de agua, acoplamientos estuarinos-costeros, plumas de ríos y circulación en dos capas de un estuario (Nocross y Shaw, 1984 y Sánchez Ramírez, 1997). Estas características pueden influir potencialmente sobre la sobrevivencia, dispersión y reclutamiento de los organismos en el zooplancton. Por otro lado, las pautas de estacionalidad de los ciclos de producción varían geográficamente y por lo general están determinadas por la disponibilidad de nutrientes y las relaciones fitoplancton-zooplancton, entre otros (Baudini,1997). Por tal motivo, entender y describir el comportamiento entre los procesos físicos y la dinámica de las comunidades planctónicas ha sido objeto de estudio principalmente al Norte del Pacífico, el Golfo de California y la Península de Baja California, así como el Golfo de México, entre otros (Farger y McGowan, 1988; Nuñez Moreno, 1996; Lavaniegos et al., 1998; Sánchez Ramírez, 1997), en tanto que para el Pacífico Centro las aportaciones han sido muy limitadas (Acal, 1991). Algunos de los estudios que se han llevado a cabo en el área son los siguientes: Filonov et al., 2000 describen la estructura termohalina en las costas de Jalisco, asimismo temas que abordan aspectos de la biomasa zooplanctónica (Franco-Gordo et al., 2001 y 2004; Navarro-Rodríguez et al., 2002). Sobre ecología del ictioplancton desarrollado a gran escala están los trabajos de Ahlstrom (1971 y 1972) y de forma local los de Navarro (1995), Franco-Gordo et al., (2001), Navarro-Rodríguez et al., (2001), Flores-Vargas et al., (2004), Navarro-Rodríguez y Flores-Vargas 2006, Franco-Gordo et al., 2008) y Silva-Segundo et al., 2008). Estudios sobre lagunas costeras y estuarios en México fueron relativamente escasos hasta los años setenta (Ayala-Castañeda y Phleger, 1969). Condición que poco a poco cobra importancia y se manifiesta con los trabajos principalmente para el Pacífico Centro, incluyendo el área de estudio, como el de Sandoval-Rojo et al., (1988), Álvarez del Castillo et al., (1992), Rodríguez-Cajiga (1993), Navarro-Rodríguez et al., (2004 y 2006), Meyer-Willerer et al., (2006). Cabe mencionar que el presente trabajo es el primer estudio sobre zooplancton en general que se realiza en el estero El Salado, por lo que el principal objetivo es analizar la variación estacional en espacio y tiempo así como la densidad de la abundancia de los grupos zooplanctónicos presentes. |
Zooplanktonic biomass has been widely recognized as an important indicator to estimate the variability of secondary production (Kane, 1993), therefore it is the main component in the aquatic food chain, since it conforms a heterogeneous collection that includes a great variety of taxa of diverse size, shape and chemical composition (Cifuentes et al., 1997). It is described as a transcendental component of energy transference in the trophic levels of pelagic systems, meaning, it works as a link between primary and secondary producers (Heinrich, 1962; Shernana et al., 1983; Álvarez-Silva et al., 2006). Mullin et al., (1997) states that between the zooplankton and the ichthyoplankton there are reciprocal alimentary relations established that represent great importance since they intervene sometimes and decisively in the regulation of the sizes of stocks of some fish species, since the availability of microzooplankton is determining in the survival rate of larvae of fishes in the oceans, considering the availability of food as good indicator (Sánchez Ramírez, 1997). Extremely important characteristics that intervene in the distribution patterns and biomass abundance are the physical and dynamic conditions of water mass in which they are found, and that at the same time allow the adaptation of several animal taxa to relatively narrow intervals of temperature and salinity (Sábates et al., 1989). On the other hand, this distribution is controlled by both active behavior and passive transportation mechanisms as well as some physical factors, which include hydrographic events and ocean and coastal toads, as well as upwelling systems, fronts, winds, water column stratification, estuary-coastal couplings, river banks and circulation in two layers of an estuary (Nocross and Shaw, 1984 and Sánchez Ramírez, 1997). These characteristics might potentially influence on the survival, dispersion and recruitment of organisms in the zooplankton. In contrast, the seasonal patterns of production cycles vary geographically, and are generally determined by the availability of nutrients and the relations phytoplankton-zooplankton, among others (Baudini, 1997). Therefore, understanding and describing the behavior between the physical processes and the dynamics of the plankton communities has been the object of study mainly in North Pacific, Gulf of California and Baja California Peninsula, as well as the Mexican Gulf, amongst others (Farger and McGowan, 1988; Nuñez Moreno, 1996; Lavaniegos et al., 1998; Sánchez Ramírez, 1997), whilst in the Central Pacific contributions have been very limited (Acal, 1991). Some of the studies that have been carried out in the area are: Filonov et al., (2000) describe the thermohaline structure in the coasts of Jalisco and topics that discuss aspects of the zooplanktonic biomass (Franco-Gordo et al., 2001 and 2004; Navarro-Rodríguez et al., 2002). On ichthyoplankton ecology developed at a great scale, we can find papers from Ahlstrom (1971 and 1972) and locally the ones from Navarro (1995), Franco-Gordo et al., (2001), Navarro-Rodríguez et al., (2001), Flores-Vargas et al., (2004), Navarro-Rodríguez and Flores-Vargas (2006), Franco-Gordo et al., (2008) and Silva-Segundo et al., (2008). Studies on coastal lakes and estuaries in Mexico were relatively scarce until the 70’s (Ayala-Castañeda and Phleger, 1969). Condition that little by little increased in importance and manifested with the papers for the Central Pacific mainly, including the area of study, as the one of Sandoval-Rojo et al., (1988), Álvarez del Castillo et al., (1992), Rodríguez-Cajiga (1993), Navarro-Rodríguez et al., (2004 and 2006); Meyer-Willerer et al., (2006). It should be noted that this paper is the first study on zooplankton performed in the estuary el Salado, hence its main objective is to analyze seasonal variation in time and space as well as density in abundance of present zooplanktonic groups. |
||
| Área de estudio | Field of study | ||
El estero El Salado se localiza en el Municipio de Puerto Vallarta, Jalisco, es uno de los sistemas estuarinos más importantes de la región, se encuentra sobre la planicie costera del Pacífico en el punto de unión de la Sierra Madre Occidental y la Sierra Madre del Sur, configurando la Bahía de Banderas. Este cuerpo costero se desarrolla sobre el delta del río Ameca y se ubica entre los 20° 39’ y 20° N y 105° 13’ y 105° 15’ O. Presenta una extensión total de 75 km2, su conexión al océano es permanente a través de un canal de aproximadamente 2 km de largo, 20 m de ancho y una profundidad aproximada de 3 m; la profundidad media en marea baja es de 3 m y en marea alta es de 5.7 m, las mareas se presentan de tres a cuatro veces al día, ocurriendo las más bajas durante los meses de enero y febrero y las más altas de septiembre a octubre. Se encuentra rodeado por vegetación de manglar y marismas así como por dos remanentes de selva mediana subcaducifolia bordeada por sucesiones de elementos de vegetación acuática y subacuática (Cupul-Magaña, 1998; Cupul-Magaña, 2000) (Figura 2). El clima del estero es de tipo semicálido subhúmedo fresco de tipo (Awo (x´) I) donde la temperatura y la precipitación pluvial promedio anual oscilan entre los 26 °C a 28 °C y los 930.8 mm a 1,680.0 mm, respectivamente (García, 1981). |
The estuary El Salado is located in the municipality of Puerto Vallarta, Jalisco Mexico. It is one of the most important estuary systems in the region, it is located on the coastal plain of the Pacific, in the joint point of the Sierra Madre Occidental and the Sierra Madre del Sur, conforming what is known as the Bahia de Banderas. This coastal body is developed on the delta of the Ameca River and it is located between the 20° 39’ and 20° N and 105° 13’ and 105° 15’ O. It has a total extension of 75 km2, its connection to the ocean is permanent through a channel of approximately 2 km length, 20 m width and an approximate depth of 3 m, the average depth in low tide is 3 m and in high tide is 5.7 m, tides are present from three to four times a day, the lowest occurring during the months of January and February, and the highest from September to October. It is surrounded by mangrove and marshlands as well as two remnants of medium subdeciduous forest bordered by successions of elements of aquatic and subaquatic vegetation (Cupul-Magaña, 1998; Cupul-Magaña, 2000) (Figure 2). The climate in the estuary is mild sub-humid fresh type (Awo (x´) I) where temperature and average pluvial precipitation estuary 26 °C to 28 °C and 930.8 mm to 1,680.0 mm, respectively (García, 1981). |

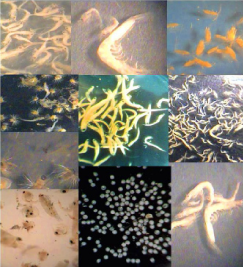
Figura 1. Algunos de los diferentes grupos zooplanctónicos observados en el estero El Salado, Jalisco, México
Figure 1. Some of the different zooplankton groups observed in the estuary El Salado, Jalisco, Mexico

Figura 2. Área de estudio y sitios de muestreo, estero El Salado, Jalisco, México
Figure 2. Study area and sampling sites, estuary El Salado, Jalisco, Mexico
Materiales y Métodos |
Methods and Materials |
||
En el área de estudio fueron ubicados dos sitios de muestreo en los primeros metros del canal principal, el primer sitio se localizó del puente vehicular hasta donde la vegetación permitió el paso con la embarcación existiendo una distancia de 573.5 m, y el segundo sitio fue ubicado de la boca al puente que atraviesa el estero existiendo una distancia de 499.5 m, abarcando una superficie total del área de 1,073 m2. Las muestras se obtuvieron estacionalmente mediante ocho arrastres de primavera a invierno del 2001, empleando la metodología estándar descrita por Smith y Richardson (1977); utilizando una lancha con motor fuera de borda y una red tipo Zeppelín, de luz de malla 505 µm por 1.50 m de longitud y 0.60 m de diámetro de la boca, equipada con flujómetro digital para medir el volumen de agua filtrada. Los arrastres fueron realizados con una duración de 10 minutos y bajo condiciones de marea alta, apoyándose en las tablas de marea emitidas por el Departamento de Oceanografía Física del CICESE (Centro de Investigación Científica y Educación Superior de Ensenada) y a 10 cm por debajo de la superficie del agua para evitar tomar materia orgánica suspendida, de forma simultánea, en cada sitio de muestreo se obtuvieron los datos de temperatura y salinidad superficial por medio de un termómetro de inmersión graduado (0.1 °C de precisión) y un refractómetro de campo (ATAGO s/mill-E, de 0-100 ‰ al 1 ‰ ups de precisión), respectivamente. El material colectado fue colocado en frascos de plástico transparente de 1 litro de capacidad y fijado con formol al 4 % y 20 mL de una solución saturada de borato de sodio; ya en el laboratorio, los grupos zooplanctónicos fueron separados y colocados en frascos (400 y 500 mL) debidamente etiquetados para su posterior identificación. Las principales fuentes bibliográficas utilizadas fueron Biguelow (1926), Boltovskoy (1981), Gómez Aguirre (1981), Palomares et al., (1998), Jiménez y Lara (1990) y estandarizados a un volumen de mL/1000 m3 de agua filtrada mediante la siguiente fórmula:
Donde E=abundancia estandarizada, n=número de organismos y v=volumen filtrado del agua. |
In the area of study, two sampling sites were located in the first meters of the principal channel, the first site was located from the vehicular bridge to the place where the vegetation allowed the crossing of the vessel, existing a distance of 573.5 m, and the second site was located from the mouth to the bridge that crosses the estuary, existing a distance of 499.5 m, with a total area surface of 1,073 m2. Samples were obtained stationary through eight trawls from spring to winter 2001, by using the standard methodology described by Smith and Richardson (1997); using a boat with outboard motor and a Zeppelin type net, a mesh size of 505 µm with a length of 1.50 m mouth width of 0.60 m which was equipped with a digital flow meter to calculate the volume of filtered water. Trawls were made with a duration of 10 minutes and under high tide conditions, based on the tide tables issued by the Physical Oceanography Department of CICESE (Scientific Investigation Center and Superior Education of Ensenada) and at 10 cm under water surface to avoid taking organic matter suspended, simultaneously, in each sampling site, temperature and superficial salinity data were obtained through a graduated immersion thermometer (precision of 0.1 °C) and a field refractometer (ATAGO s/mill-E, from 0-100 ‰ to 1 ‰ psu accuracy) respectively. The collected material was placed in 1 liter transparent plastic bottles and formaldehyde at 4 % and 20 mL of a saturated sodium borate solution; once in the laboratory, zooplanktonic groups were separated and placed in bottles (400 and 500 mL) properly labeled for posterior identification. Main bibliographic references used were Biguelow (1926), Boltovskoy (1981), Gómez Aguirre (1981), Palomares et al., (1998), Jiménez and Lara (1990) and standardized to a volume of mL/1000 m3 of filtered water through the next formula:
Where E=standardized abundance, n=number of organisms and v=filtered volume of water. |
Resultados y Discusión |
Results and Discussion |
||
Con respecto a la temperatura y salinidad, se observó una clara influencia por las condiciones climáticas de la temporada, de esta forma durante el verano se registró el valor máximo de 29.25 °C mientras que para el invierno se obtuvo un valor mínimo de 23.3 °C, respecto a la salinidad, durante el verano disminuyó alcanzando valores mínimos de 6.5 ups, periodo en el que el cuerpo de agua estuvo sujeto principalmente a escorrentías y descargas pluviales, para posteriormente estabilizarse durante el otoño e invierno manteniendo alrededor de los 35 ups, observando en general una mayor estabilidad en la temperatura que en la salinidad (Figura 3). Los patrones de distribución espacio temporal de los grupos zooplanctónicos posiblemente estuvieron influenciados principalmente por las condiciones de corrientes locales debido a que este cuerpo de agua tiene comunicación permanente con el mar, por el efecto de las mareas, así como por las precipitaciones pluviales (junio-octubre) y por la percolación del mar adyacente. Navarro-Rodríguez et al., (2001) en un estudio realizado en las costas de Jalisco y Colima, identificaron tres períodos que se relacionan con el patrón estacional de corrientes del Pacífico Oriental (Instituto Oceanográfico del Pacífico, 1993; Wirtky 1996, Badan 1997), un período “cálido” que es caracterizado por altas temperaturas en verano, que puede ser relacionado con la intensificación de la Corriente Costera de Costa Rica, un segundo período de menor temperatura en invierno, que puede ser relacionado con el desplazamiento de la Convergencia Intertropical, al mismo tiempo que la Corriente costera de Costa Rica está muy debilitada. Finalmente, un tercer período de transición que se caracteriza por un incremento en la temperatura en primavera y verano, situación que es observada en el presente trabajo. Por su parte, Flores-Verdugo et al., (1989) indican que el grado de exportación o reciclamiento dentro del propio ecosistema va a depender, en gran parte, de las características geomorfológicas, intensidad de las mareas y los aportes fluviales. El material analizado proviene de ocho muestras obtenidas de primavera a invierno (dos muestras por periodo estacional), logrando la identificación de once grupos zooplanctónicos, de los cuales, los de mayor abundancia estuvieron representados principalmente por las larvas de braquiuros capturados a lo largo de toda la temporada de estudio, representando el 44.5 % de la captura total; otro grupo que no fue muy frecuente pero sí muy abundante durante otoño e invierno, fue el de los quetognatos con el 24.1 %, como tercer grupo encontramos a los eufáusidos que representaron el 11.84 %, los grupos que registraron menores abundancias fueron los decápodos con el 6.78 %, seguidos por los copépodos con un 6.18 %, los sifonóforos y pequeñas medusas con 3.37 %, los estomatópodos 2.83 %, anfípodos 0.22 %, cladóceros con 0.33 % y gasterópodos con el 0.08 % y finalmente los organismos poco frecuentes o raros (apendiculados, poliquetos y cumaceos) representados únicamente por el 0.02 % (Figura 4). Respecto a la densidad total obtenida durante los cuatro periodos estacionales, se observó que altas densidades se presentaron principalmente en el invierno con un total de 52,255 organismos/1000 m3, representados principalmente por quetognatos, copépodos y carideos, en tanto en el verano fue de 47,849.5 organismos/1000 m3, con las mayores densidades para los braquiópodos, carideos y copépodos, respecto al período de otoño ésta fue de 33,428.5 organismos/1000 m3 densidades representadas principalmente por braquiuros, quetognatos y carideos y finalmente en primavera se obtuvo una abundancia total de 1,754.67 organismos/1000 m3 representados por braquiuros, carideos y estomatópodos (Figura 5). Contreras Espinoza (1993) y Suárez Morales (1994) señalan que la relación marea-volumen y el consecuente tiempo de residencia del agua dentro del estero, propicia una máxima permanencia del zooplancton. Para cada especie hay un punto de equilibrio entre la relación del intercambio de masas de agua y el coeficiente de reproducción con el fin de mantener a la población, la incidencia zooplanctónica puede aumentar cuando la marea penetra y se mantiene, mientras que en la boca de comunicación con el mar tiende a producirse una dispersión. La densidad registrada por cada período estacional y sitio de muestreo, presentó que durante primavera, verano y otoño en la estación 2 fue regularmente homogénea, en tanto que en el invierno se presenta un incremento que alcanzó los 76,645.1 organismos /1000 m3, debido a la presencia masiva de larvas de braquiuros, lo que indica que en este grupo, aunque fueron frecuentes durante todo el año, en invierno se dispara su densidad considerablemente. En cambio en la estación 1, verano, otoño e invierno presentan un periódo de homogeneidad aún cuando las concentraciones zoopláncticas se encuentran por debajo de los 10,000 organismos/ 1000 m3, con dominio absoluto de braquiuros y quetognatos, no así para primavera que refleja un aumento en la densidad larval (20,000/1000 m3) con dominio de los carideos y braquiuros (Figura 6). Cupul-Magaña (2000), ha registrado en el área de estudio la presencia de mareas de tres a cuatro veces al día, presentándose las más bajas durante enero y febrero (invierno) y las más altas de septiembre a octubre (verano y otoño) lo que coincide con una alta densidad de estos organismos (invierno y verano), asimismo, señala que el estero presenta sus máximos aportes acuíferos durante la época de lluvias (verano), época en la que se registra el segundo valor importante de la abundancia; por otro lado, dicha época viene a favorecer la defoliación del bosque de manglar produciendo hojarasca, lo que representa uno de los aportes de materia orgánica más importantes para la economía del estero. Su incorporación a la red trófica del mismo determina en gran medida la fertilización de las aguas y la alta producción secundaria del sistema (Barreiro-Güemes, 1999; Flores-Verdugo et al., 2007), la cual está demostrada con la actividad heterotrófica asociada a mecanismos bacterianos y a una eficiente y significativa utilización del detritus (Contras Espinoza, 1993 y Suárez Morales, 1994). Por otro lado, se ha comprobado la importancia del zooplancton en el reciclamiento de nutrientes, puesto que las migraciones verticales nocturnas realizadas por dichos organismos hacia la superficie, se traducen en un importante suministro de nitrógeno (por desechos metabólicos) para el fitoplancton llamado “bioconvección” (Contras Espinoza, 1993). Por su parte Navarro-Rodríguez et al., (2004), señalan que el estero El Salado no es un sistema en el cual prevalezcan condiciones estables a largo plazo, pues durante el periodo de lluvias se ve influenciado por aguas ricas en nutrientes y materia orgánica de origen terrígeno, lo cual modifica en cierto grado las condiciones ambientales del sistema y repercute en la ocurrencia y abundancia de los diferentes grupos del zooplancton en el estero. Las características propias de los sistemas estuarinos favorecen a la crianza además de jugar un papel primordial en las estrategias de reproducción como áreas propicias en la disponibilidad de alimento y desarrollo de numerosos organismos, dado que existe una baja energía y una elevada productividad determinando que, en la mayoría de los casos, estos sistemas resulten verdaderos viveros para numerosas especies (Flores-Verdugo, 1989; Contreras Espinoza, 1993; Suárez Morales, 1994; Funes Rodríguez et al., 1998; Navarro-Rodríguez et al., 2002; Navarro-Rodríguez et al., 2006). Por otro lado, es de suma importancia establecer políticas ambientales preventivas, para lo cual es necesario conocer perfectamente las características naturales y sociales del área, de manera que las relaciones que se generan entre el desarrollo y los componentes específicos del ambiente puedan identificarse. |
In respect of temperature and salinity, a clear influence of climate conditions of the season was observed, hence during the summer the maximum value of 29.25 °C was registered, whilst for winter a minimum value of 23.3 °C was obtained; regarding salinity, during the summer it decreased reaching minimum values of 6.5 ups, period in which the body of water was subject mainly to run-offs and pluvial discharges to posteriorly be stabilized during fall and winter, maintaining around 35 ups, observing a major stability, in general, in the temperature than in salinity (Figure 3). Distribution space – time patterns of zooplanktonic groups were possibly influenced mainly by the local tide conditions due to the fact that this body of water has permanent communication with the sea, for both the tide effect and the pluvial precipitations (June – October) and the percolation of adjacent sea. Navarro-Rodríguez et al., (2001) identified three periods that are related with the seasonal patterns of tides in the Oriental Pacific, in a research made in the Jalisco and Colima coasts (Instituto Oceanográfico del Pacífico, 1993; Wirtky 1996, Badan 1997). A “warm” period is characterized by high temperatures in the summer, which can be related to the intensification of the Coastal Current of Costa Rica, a second period of lower temperature in winter, which can be related with the displacement of the Intertropical Convergence Zone, at the same time that the Coastal Current of Costa Rica is much weakened. Finally, a third period of transition that is characterized by an increase in the temperature in spring and summer, situation that is observed in this study. On the other hand, Flores-Verdugo et al., (1989) indicate that the exportation or recycling grade within the own ecosystem will depend, mostly, on the geomorphological characteristics, tide intensity and fluvial inputs. The analyzed material comes from eight samples obtained from spring to winter (two samples per seasonal period), reaching identification of eleven zooplanktonic groups, from these, those of higher abundance were represented mainly by larvae of brachyuran captured along the study season, representing 44.5 % of total capture; another group that was not quite frequent but very abundant during fall and winter was the chaetognaths with 24.1 %; as third group we find the euphausiids, which represented 11.84 %; the groups that registered minor abundances were the decapods with 6.78 %, followed by the copepods with 6.18 %, sinophophores and small jellyfish with 3.37 %, stomatopods 2.3 %, amphipods 0.22 %, cladocerans with 0.33 % and gastropods with 0.08 %, and finally, rare or low frequent organisms (appendicular, polychaetes and cumaceans) represented only with 0.02 % (Figure 4). In respect of total density obtained during the four seasonal periods, it was observed that high densities were present mainly in winter with a total of 52,255 organisms/1000 m3, represented mainly by chaetognaths, copepods and caridea, while in summer it was of 47,849.5 organisms/1000 m3, with higher densities for brachiopods, caridea and copepods; regarding fall, it was of 33,428.5 organisms/1000 m3 density, represented mainly by brachyuran, chaetognaths and caridea, and finally, in spring, the total abundance obtained was 1,754.67 organisms/1000 m3, represented by brachyuran, caridea and stomatopods (Figure 5). Contreras Espinoza (1993) and Suárez Morales (1994) state that the relation tide-volume and the consequent resident water time within the estuary fosters a maximum permanence of zooplankton. For each species there is an equilibrium point between the exchange relation of water mass and the reproduction coefficient with the aim of maintaining population, they affirm that the zooplanktonic incidence can increase when the tide penetrates and is steady, while in the mouth of communication with the sea, it tends to produce adispersion. Registered density in each seasonal period and sampling site showed that, during spring, summer and fall, in season 2 was regularly homogeneous, while in winter it presents and increase that reached the 76,645.1 organisms/1000 m3, due to the massive presence of brachyuran, which indicates that in this group, although frequent during all the year in winter, its density increases considerably. In contrast, in season 1 summer, fall and winter present a homogeneity period even when zooplanktonic concentrations are found under the 10,000 organisms/1000 m3, with absolute dominium of brachyuran and chaetognaths, not so for spring, which reflects an increase in larvae density (20,000/1000 m3) with caridea and brachyuran dominium (Figure 6). Cupul-Magaña (2000) has registered in the study field the presence of tides from three to four times a day, presenting the lowest during January and February (winter) and the highest from September to October (summer and fall), which coincides with a high density of these organisms (winter and summer); likewise, it is affirmed that the estuary presents its maximum aquifer contributions during rainy season (summer), time when the second important abundance value is registered; on the other side, such time favors defoliation of the mangrove forest producing leaf litter that represents one of the most important contributions in organic matter for the estuary’s economy. Its incorporation to the trophic net determines in great number the fertilization of the waters and the high secondary production of the system (Barreiro-Güemes, 1999; Flores-Verdugo et al., 2007), which is demonstrated by the heterotrophic activity associated to bacteria mechanisms and an efficient and significant use of detritus (Contras Espinoza, 1993 and Suárez Morales, 1994). On the other hand, the importance of zooplankton has been proven in the recycling of nutrients, since vertical nocturnal migrations made by such organisms towards the surface translates into an important nitrogen supply (for metabolic disposal) for the phytoplankton called “bio-convection” (Contras Espinoza, 1993). Navarro-Rodriguez et al., (2004), state that the estuary El Salado is not a system in which stable conditions prevail in the long term, since during the rainy season it is influenced by water rich in nutrients and terrigenous origin organic matter, which modifies to a certain point the environmental conditions of the system and impacts in the occurrence and abundance of the different groups of zooplankton in the estuary. The specific characteristics of the estuary systems favor the breeding and also play an important role in the reproduction strategies such as proper areas in food availability and development of a great number of organisms, since there is low energy and an elevated productivity, determining that, in most of the cases, these systems turned to be real nurseries for numerous species (Flores-Verdugo, 1989; Contreras Espinoza, 1993; Suárez Morales, 1994; Funes Rodríguez et al., 1998; Navarro-Rodríguez et al., 2002; Navarro-Rodríguez et al., 2006). On the other hand, it is important to establish preventive environmental policies, hence it is necessary to know perfectly the natural and social characteristics of the area, so the relations generated between the development and the specific components of the environment can be identified. |

Figura 3. Variación estacional de la temperatura (°C) y salinidad (ups) en el estero El Salado, Jalisco, México
Figure 3. Seasonal variation of temperature (°C) and salinity (psu) in the estuary El Salado, Jalisco, Mexico

Figura 4. Porcentaje de abundancia de los grupos zooplanctónicos en el estero El Salado Jalisco, México
Figure 4. Percentage of abundance of zooplankton groups in the estuary El Salado Jalisco, Mexico
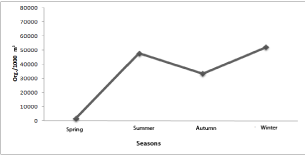
Figura 5. Abundancia total (organismos/1000 m3) estacional en el estero El Salado Jalisco, México
Figure 5. Total seasonal abundance (organisms/1000 m3 in the estuary El Salado Jalisco, Mexico
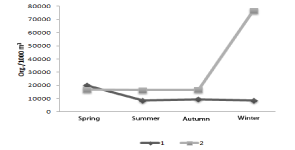
Figura 6. Densidad (organismos /1000 m3) espacio temporal en el estero El Salado Jalisco, México
Figure 6. Density (organisms / 1000 m3) temporary space in the estuary El Salado Jalisco, Mexico
Literatura citada / References
Anónimo. 2010. Clima en Acapulco. Est. Meteor. 768050 (Coordenadas: Latitud: +16º83 N, Longitud: -099º93 W). Alpred, S. L. Murcia, España. http://clima.tiempo.com/clima-en-acapulco-768050-2010.
Bejarano-Angulo, N. R. (1985). Abundancia, diversidad y distribución de los géneros de diatomeas en la Bahía de Acapulco agosto/84-enero/85. Tesis Profesional. Unidad Académica de Ecología Marina, Univ. Autón. de Gro., 24 pp.
Cabrera-Mancilla, E., Ramírez-Camarena, L., Muñoz-Cabrera, A. and Monreal-Prado. 2000. Primer registro de Gymnodinium catenatum Graham (Gymnodiniaceae) como causante de marea roja en la Bahía de Acapulco, Guerrero. México. pp. 85-86. In: Ríos-Jara, Juárez-Carillo, E.E., Pérez-Peña, M., López-Uriarte, E., Robles-Jarero, E.G.D.,
Hernández-Becerril, U., Silva-Briano, M. (eds). Estudios sobre plancton en México y el Caribe. Sociedad Mexicana de Planctonología y Universidad de Guadalajara.
Castillo, F. 1984. Fitoplancton del Pacífico colombiano como indicador de masas de agua. Erfen IV. Biología pesquera 13: 67-70. http://biblat.unam.mx/es/revista/biologia-pesquera
Castillo, F. and Vidal, A. 1982. Fitoplancton del Pacífico colombiano como indicadores de masas de agua. Fase Centro de Investigaciones Oceanográficas e Hidrográficas del Caribe, Cartagena 1-57.
Cortés-Altamirano, R. 1998. Informe regional sobre mareas rojas en México. IOCARIBE-ANCA. II Taller regional, Ciudad de la Habana, Cuba, 4 pp.
Díaz-Ortiz, J., Pérez, B., Alarcón, M., Torres, A., Alarcón, M. and López, S. 2007. Eventos de marea roja tóxicas en la costa del estado de Gro. y su impacto en la salud pública periodo 1992-2007. XII Foro de Estudios sobre Guerrero, 275-277 pp.
Digby, P. and Kempton, R. 1987. Multivariate analysis of ecological communities, Chapman and Hall, London, 204 pp.
Gárate-Lizárraga, I., Pérez-Cruz, B., Díaz-Ortíz, J. and Band-Schmidt, C.J. 2008. Microalgas y biotoxinas marinas en las costas mexicanas. Conversus 9: 22-26. http://www.researchgate.net/publication/260202139_Microalgas_y_biotoxinas_marinas_en_las_costas_mexicanas
Gárate-Lizárraga, I., Sevilla-Torres, G., Álvarez-Añorve, M., Aguirre-Bahena, F., Violante-González, J. and Rojas-Herrera, A. 2013. First Record of a red tide caused by Gyrodinium instriatum (Dinophyceae: Gymnodiniales) in Bahía de Acapulco, Guerrero. Centro Interdisciplinario de Ciencias Marinas (CICIMAR) Oceánides 28(1): 43. 47. http://www.cicimar.ipn.mx/oacis/Medios/oceanides/P%20043-47.pdf
Gárate-Lizárraga, I., Díaz-Ortíz, J., Pérez-Crúz, B., Alarcón, M.A., Salgado, P. and López, S. 2009. Florecimientos de Cochlodinium polykrikoides y Gymnodinium catenatum en la bahía de Acapulco, Guerrero, México (2005-2008) Resúmenes III Taller sobre Florecimientos Algales Nocivos, Acapulco, Guerrero. 14-17 pp.
Gárate-Lizárraga, I., Hernández-Orozco, M.L., Band-Schmidt, C.J. and Serrano-Casillas, G. 2001. Red tides along the coasts of the Baja California Península, México (1984 to 2001). Oceánides, 16: 127-134. http://biblat.unam.mx/es/revista/oceanides-la-paz-b-c-s/2 http://biblat.unam.mx/es/revista/oceanides-la-paz-b-c-s/2
Hernández-Becerril, D.U. 2000. Morfología y taxonomía de algunas de las especies de diatomeas del género Coscinodiscus de las costas del Pacífico mexicano. Revista de biología Tropical 48: 7-18. http://biblat.unam.mx/es/revista/revista-de-biologia-tropical/26
Hernández-Becerril, D.U. 2003. Diversidad del fitoplancton marino de México. Un acercamiento actual. pp. 1-18. Cap. 1. En: Planctonología Mexicana. Barreiro-Güemes M. T., M. E. Meave del Castillo, M. Signoret-Poillon, M. G. Figueroa-Torres (eds.). Sociedad Mexicana de Planctonología, A. C. México.
Krebs, C. J. 1999. Ecological methodology. Addison-Welsey Educational Publishers, Inc. Boston, Massachusetts, 654 pp.
Langlois, G. W and Smith, P. 2001. Phytoplankton In: Biology and Ecological Niches in the Gulf of the Farallones: U.S. Geological Survey, Reston, Virginia, 32-35 pp.
Licea, S.J.L., Moreno, H., Santoyo and Figueroa, G. 1995. Dinoflagelados del Golfo de California. México. Universidad Autónoma de Baja California Sur, México, 165 pp.
Ludwig, J.A. and Reynolds, J.F. 1988. Statistical ecology. pp. 337. A primer on methods and computing. John Wiley & Sons, New York.
Magurran, A. 1991. Ecological diversity and its measurement. Princeton University Press, Princeton, New Jersey, 178 pp.
Margalef, R. 1980. La Biosfera. Entre la termodinámica y el juego, pp.236 Omega, Barcelona.
Margalef, D.R. 1981. Ecología. (5ª Ed.) Omega. Barcelona, España. 951 pp.
Meave-del Castillo, M.H., Zamudio-Resendiz, M.E. and Castillo-Rivera, M. 2012. Riqueza fitoplanctónica de la Bahía de Acapulco y zona costera aledaña, Guerrero, México . Acta Botánica Mexicana 100: 405-487.
http://actabotanicamexicana.blogspot.mx/2012/07/riqueza-fitoplanctonica-de-la-bahia-de.html
Moreno, J. L., Licea, S. and Santoyo, H. 1995. Diatomeas del Golfo de California. México. Universidad Autónoma de Baja California Sur, México, 273 pp.
Moreira, A., Seisdedo, M. l., Leal, S., Comas, A., Delgado, G., Regadera, R., et al. 2007. Composición y abundancia del fitoplancton de la Bahía de Cienfuegos, Cuba. Revista de Investigaciones Marinas 28: 97-109. http://www.cim.uh.cu/rim/pdf/2007/2/2007-097.pdf
Ochoa, N. and Tarazona, J. 2003. Variabilidad temporal de pequeña escala en el fitoplancton de Bahía Independencia, Pisco, Perú. Revista Peruana de Biología 10: 59-66. http://www.researchgate.net/publication/262592570_Variabilidad_temporal_de_pequea_escala_en_el_fitoplancton_de_Baha_Independencia_Pisco_Per
Örnólfsdóttir , E. B., Lumsden, E. and Pinckney, J.L. 2004. Phytoplankton community growth-rate response to nutrient pulses in a shallow turbid estuary, Galveston Bay, Texas. Journal of plankton research 26: 325-339. http://plankt.oxfordjournals.org/content/26/3/325.full.pdf+html
Peña, V. and Pinilla, G.A. 2002. Composición, distribución y abundancia de la comunidad fitoplanctónica de la ensenada de Utría, Pacífico colombiano. Revista de Biología Marina y Oceanografía 37: 67-81. http://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0718-19572002000100008&lng=en&nrm=iso&ignore=.html
Pérez-Castro, D. 1984. Claves de identificación de diatomeas de la Bahía de Acapulco. Tesis Profesional. Universidad Autónoma de Morelos. 74 pp.
Rojas-Herrera, A.A., Violante-González, J., García-Ibáñez, S., Sevilla-Torres, V.M.G., Gil-Guerrero, J.S. and Flores-Rodríguez, P. 2012. Temporal variation in the phytoplankton community of Acapulco Bay, Mexico. Microbiology Research 3(1): 13-19. http://www.pagepress.org/journals/index.php/mr/article/view/mr.2012.e4
Round, F.E., Crawford, R.M. and Mann, D.G. 1990. The Diatoms. Biology and morphology of the genera. Cambridge. University Press. 747 pp.
Sánchez, E. 1996. Caracterización espacial del fitoplancton nerítico en el Pacífico Colombiano durante julio-agosto de 1994. Tesis de Biólogo, Facultad de Ciencias, Universidad del Valle, Cali, Colombia. 60 pp.
Silver, W. and Platt, T. 1978. Energy flux in the pelagic ecosystem: A time-dependent equation. Limnology Oceanography 23(4): 813-816. http://onlinelibrary.wiley.com/doi/10.4319/lo.1978.23.4.0813/abstract;jsessionid=B63DF26F59DD8E5FEB05EF1815452957.f01t02
Steel, J.H. 1976. Patchiness. pp. 98-115. In: the Ecology of the seas. D.H. Cushing y Walsh J.J. (Eds) Blackwell Scientific Publications, Londres, Gran Bretaña.
Tomas, C.R. 1997. Identifying Marine Phytoplankton. Academic Press. San Diego. USA. 858 pp.
Vargas-Montero, M., Bustamante, E.F., Guzmán, J.C. and Vargas, J.C. 2008. Florecimientos de dinoflagelados nocivos en la costa Pacífica de Costa Rica. Hidrobiológica 18: 15-23. http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0188-88972008000400005&lng=es&nrm=iso&tlng=es
Varona-Cordero, F. and Gutiérrez-Mendieta, F.J. 2006. Composición estacional del fitoplancton de dos lagunas del Pacífico tropical. Hidrobiológica 16: 159-174. http://investigacion.izt.uam.mx/rehb/publicaciones/16-2PDF/159-174_Varona.pdf