Mancillas Flores PF1, Rodríguez Muela C1*, Díaz Plascencia D1, Arzola Alvarez CA1,
Grado Ahuir JA1, Corral Flores G1, Castillo Castillo Y2.
1Universidad Autónoma de Chihuahua, Facultad de Zootecnia y Ecología, Periférico
Francisco. R. Almada Km. 1, CP 31453, Chihuahua, Chihuahua, México.
2Universidad Autónoma de Ciudad Juárez, División de Ciencias Biológicas, Av. Universidad
No. 3003, Sección Hidalgo, C.P. 31803, Nuevo Casas Grandes, Chihuahua, Chihuahua, México.
*Autor corresponsal:
Rodriguez Muela C. Facultad de Zootecnia y Ecología, Universidad Autónoma de Chihuahua, Periférico Francisco. R. Almada Km. 1, CP 31453, Chihuahua, Chihuahua México. Tel. y Fax.: (614) 434 0303. Correo electrónico:
crmuela@gmail.com
Información del Artículo
Recibido: 29 de enero de 2013
Aceptado: 06 de Junio de 2013
Revista Bio Ciencias 2(3): 189-199
Como citar este artículo: Mancillas Flores PF, Rodríguez Muela C, Díaz Plascencia D, Arzola Alvarez CA, Grado Ahuir JA, Corral Flores G, Castillo Castillo Y. Digestibilidad in vitro de dietas para becerros en crecimiento adicionadas con inoculo de levaduras y bagazo de manzana fermentado. Revista Bio Ciencias. 2013; 2(3): 189-199.
Palabras Claves / Key Words
Bagazo de manzana, Digestibilidad In vitro; Fermentación, Levaduras / Apple bagasse, In vitro digestibility, Fermentation, Yeast
Resumen
Se empleo la técnica de digestibilidad in vitro para evaluar el efecto de la adición de un inóculo de levadura y de bagazo de manzana fermentado en dietas de becerros en crecimiento. Los tratamientos consistieron en: T0 (testigo): heno de avena (HA), ensilaje de maíz (SM) y concentrado; T1 (BMZN): HA, SM y concentrado con 12 % de bagazo de manzana fermentado (BMZN); T2 (IL): HA, SM y concentrado con 2 % de inóculo de levaduras (IL). Se realizó un análisis de varianza en un diseño completamente al azar, tomando muestras por triplicado de cada tratamiento, para medir digestibilidad in vitro de materia seca (MS), de fibra detergente neutro (FDN), de fibra detergente ácido (FDA) y contenido de lignina detergente ácido (LDA) durante 48 h. Así mismo, para evaluar la producción de gas (PG) in vitro, se midieron ácido acético, ácido propiónico, ácido butírico, además, nitrógeno amoniacal (N-NH3), ácido láctico y pH a las 3, 6, 12, 24, 48, 72 y 96 h. El T1 y T2 mostraron diferencia significativa (p<0.05) en la digestibilidad de MS, FDN, FDA y LDA. El T2 fue superior (p<0.05) al T1 y T0 en la PG a las 24, 48, 72 y 96 h. La mayor producción (p<0.05) de AGV lo presentaron el T1 y T2. Estos últimos, mostraron un incremento (p<0.05) en la concentración de N-NH3 y una disminución (p<0.05) de Ác. Láctico, siendo el T2 superior (p<0.05) en el pH. La adición de un IL y de BMZN en la alimentación de becerros en crecimiento es una alternativa ya que mejoran las características nutricionales y fermentativas de la dieta.
Abstrac
The technique of in vitro digestibility was employed to evaluate the effect of the addition of an inoculum of yeasts and fermented apple bagasse in the diet of growing calves. The treatments consisted in: T0 (witness): oat hay (OH), corn silage (CS) and concentrated; T1 (BMZN): OH, CS, concentrated with 12 % of fermented apple bagasse (FAB); T2 (IL): OH, CS, concentrated with 2 % of yeast inoculums (YI). An analysis of variance was performed in a completely randomized design, taking samples in triplicate for each treatment, for measuring digestibility in vitro of matter dry (MD), neutral detergent fiber (NDF), acid detergent fiber (ADF) and acid detergent lignin (ADL) content for 48 hours. Likewise, to evaluate the in vitro gas production (GP), acetic acid, propionic acid, butyric acid, in addition, ammoniacal nitrogen (NH3-N), lactic acid and pH were measured at 3, 6, 12, 24, 48, 72 and 96 h. T1 and T2 showed a significant difference (p<0.05) digestibility of MD, NDF, ADF and ADL. T2 was superior to T1 and T0 in the GP at 24, 48, 72 and 96 h. The increased production (p<0.05) of VFA presented it the T1 and T2. The latter, showed an increase (p<0.05) in the NH3-N concentration and a decrease (p<0.05) in lactic acid, being higher in pH T2. The addition of an IL and BMZN in the diet of growing calves is an alternative since they improve the nutritional and fermentation characteristics of diet.
Introducción
El valor nutritivo de los alimentos se encuentra determinado por la biodisponibilidad de nutrientes y la dinámica de los procesos de solubilidad en el tracto gastrointestinal. Van Soest (1994) mencionó que la pared celular es el mayor constituyente orgánico de los forrajes, ya que comprende del 40 al 80 % de la materia seca y está constituida por polisacáridos estructurales como celulosa, hemicelulosa y lignina. Diversas estrategias han sido utilizadas para mejorar la digestibilidad de los forrajes, tal como los avances agronómicos y programas de cruzamientos de forrajes (Beauchemin et al., 2003).
En años anteriores, se han utilizado los cultivos de levaduras (CL) para mejorar el valor nutritivo y la utilización eficiente de los forrajes de baja calidad. La adición de CL en dietas para rumiantes pueden incrementar el consumo de materia seca, rendimiento productivo, degradación de celulosa y la digestibilidad de nutrientes (Lesmeister et al., 2004). Así mismo, Haddad y Goussous (2005) publicaron que la adición de CL en dietas altas en energía para corderos en finalización, incrementaron la ganancia de peso, la digestibilidad de la materia seca (MS), materia orgánica (MO), proteína cruda (PC) y fibra detergente neutra (FDN). Por otro lado, Bruni y Chilibroste (2001) mencionaron que de manera alternativa a la desaparición de sustrato, se mide la producción acumulada de gas como indicador del metabolismo del carbono, centrando su atención en la acumulación de los productos finales de la fermentación tales como bióxido de carbono (CO2), metano (CH4) y ácidos grasos volátiles (AGV).
Por lo anterior, el objetivo del estudio fue evaluar la digestibilidad in vitro de dietas para becerros en crecimiento adicionadas con inóculo de levaduras y de bagazo de manzana fermentado.
Materiales y Métodos
Esta investigación se realizó en el Laboratorio de Nutrición Animal de la Facultad de Zootecnia y Ecología de la Universidad Autónoma de Chihuahua, Chih., México.
Tratamientos experimentales
Se utilizaron tres dietas para becerros en crecimiento (NRC, 1996), las cuales se ofrecieron durante 84 días (d) que duro la prueba: T0 (testigo): 1.2 kg de heno de avena (HA), 1.7 kg de ensilaje de maíz (SM) y 1.2 kg de concentrado en base a MS/animal/dia; T1 (BMZN): HA, SM y concentrado + bagazo de manzana fermentado (BMZN); T2 (IL): HA, SM y concentrado + inóculo de levaduras (IL; Tabla 1).
A los 12 kg de BMZN se le añadieron urea, sulfato de amonio y premezcla de minerales y vitaminas (52, 13 y 28 g), mezclándose en un fermentador aeróbico por 72 h, manteniendo el mezclado por 15 min en cada tiempo (0, 6, 12, 24, 48 y 72 h).
Tabla 1.
Composición del alimento concentrado
por tratamiento
Ingredientes |
T0 |
T1 |
T2 |
|
% (BS) |
||
Maíz rolado |
32.0 |
30.6 |
32.0 |
Melaza |
10.0 |
5.0 |
8.0 |
Harinolina 41 % PC |
20.6 |
15.0 |
20.6 |
Pasta de soya 44 % PC |
30.0 |
30.0 |
30.0 |
Carbonato de calcio |
2.4 |
2.4 |
2.4 |
BMZN2 |
0.0 |
12.0 |
0.0 |
Sal común |
2.0 |
2.0 |
2.0 |
Minerales y vitaminas12:101 |
3.0 |
3.0 |
3.0 |
Inóculo de levaduras |
0.0 |
0.0 |
2.0 |
Análisis calculado |
|||
ENg Mcal kg-1 |
1.26 |
1.25 |
1.26 |
PC % |
28.81 |
28.83 |
28.89 |
PD % |
53.91 |
51.78 |
53.07 |
Ca % |
1.67 |
1.77 |
1.68 |
P % |
0.98 |
0.99 |
0.99 |
1Mezcla de minerales y vitaminas 12:10: P, Ca y Mg (12.0, 11.5, 0.6%), Mn, Zn, Fe, Cu, I, Co y Se (2160, 2850, 580, 1100, 102, 13, 9 ppm), Vitamina A, D3 y E (220000, 24500, 30 UI/kg). 2BMZN = Bagazo de manzana fermentado.
Se utilizaron 4 matraces para preparar el IL con Saccharomyces cerevisiae (cepa 6), Issatchenkia orientalis (cepa 3), Kluyveromyces lactis (cepa 2 y 11). Cada una en 1 L de agua destilada añadiéndole urea y melaza, además sulfato de amonio y premezcla de minerales y vitaminas (0.5, 70 g y 150, 380 mg), adaptándole un oxigenador portátil durante 96 h. Al final de la fermentación se ajustaron las cantidades de cada cepa a 3.7 x 109 cel mL-1 en 500 mL por medio de diluciones, preparando un pool de 2 L de IL que se añadieron al concentrado del T2.
Análisis químico de las dietas
Se colectaron muestras de 1 kg a los 15, 43 y 71 d de la prueba para formar muestras compuestas de cada dieta, se secaron a 60 ºC por 48 h en un horno de vacio (Thelco 28) y molidas a 1 mm en un molino Wiley (A. H. Thomas, Philadelphia, PA). Posteriormente, se determinó por triplicado la MS absoluta a 105 ºC durante 8 h (AOAC, 2000).
Tabla 2.
Comportamiento en la digestibilidad in vitro de las fracciones
de la fibra entre tratamientos
Digestibilidad (%) |
Tratamiento |
EE (±)1 |
||
T0 |
T1 |
T2 |
||
MS |
64.57b |
72.02a |
72.49a |
0.82 |
FDN |
67.32b |
70.77a |
70.25a |
0.82 |
FDA |
60.53b |
64.07a |
64.56a |
0.82 |
LDA |
5.55a |
4.25b |
4.14b |
0.04 |
ab Medias con diferente literal en fila, son diferentes (p<0.05) entre tratamiento.
1EE = Error
estándar de la media.
Digestibilidad in vitro de la materia seca y nutrientes de la dieta
Previo a la incubación, las bolsas fueron sumergidas en acetona y al retirarse se dejaron secar a temperatura ambiente, enseguida se mantuvieron por 24 h a 100 ºC (Thelco 28), registrando su peso. Las muestras de las dietas (0.45 g±0.05) se colocaron por triplicado en bolsas filtro ANKOM® F57 de 25 µm, además de un blanco (sin muestra), identificadas y selladas con calor (Clamco Corp, 210-8E, CO), por jarra del incubador DAISYll. (Ankom Technology, Macedon, NY) durante 48 h a 39 ºC para la digestibilidad verdadera in vitro.
El líquido ruminal se colectó de dos vacas Herford provistas de cánula ruminal antes de ser alimentación por la mañana, las cuales recibieron una dieta para mantenimiento a base de ensilaje de maíz, teniendo agua fresca a libre acceso. El líquido ruminal fue diluido con las soluciones búfer A y B preparadas de acuerdo al protocolo recomendado por Ankom Technology®.
Después de la incubación, las bolsas se extrajeron de las jarras y se lavaron con agua de la llave, se introdujeron por 3 h a 105 ºC (Thelco 28) para determinar la digestibilidad de MS. Posteriormente, se analizaron secuencialmente la FDN y FDA (Van Soest et al., 1991) en el aparato ANKOM200 (Ankom Technology Corp., Fairport, NY) y LDA (Goering y Van Soest, 1970).
Producción de gas in vitro
Se realizó mediante el protocolo de Menke y Steingass (1988), abordando las modificaciones de Muro (2007). La incubación de las muestras (0.2 g de muestra, 10 mL de líquido ruminal y 20 mL de saliva artificial) se realizó por triplicado más un blanco (sin muestra) en cada una de las horas de incubación, se utilizaron frascos de vidrio de 50 mL, sellados con tapón de goma; colocándose en la incubadora (Shaker I2400) a 39 ºC con agitación constante (67 rpm), protegiéndolos de la luz durante la incubación. La presión interna de los frascos producto de la degradación del alimento, se midieron con un transductor de presión (FESTO®) a las 3, 6, 12, 24, 48, 72 y 96 h, mediante la punción se registro la presión acumulada (Theodorou et al., 1994). Los resultados se expresaron en mL de producción de gas (PG) por cada 0.2 g de MS (mL PG/0.2 g MS).
AGV, nitrógeno amoniacal (N-NH3) y ácido láctico (Ác. Láctico)
Se colectó una muestra de 20 mL de los frascos de PG para determinar AGV (Ác. Acético, Ác. Propiónico y Ác. Butírico), además, N-NH3 y Ác. Láctico a las 3, 6, 12, 24, 48, 72 y 96 h, la muestra se filtro con dos capas de gasas para separar el contenido sólido y líquido. A este último, se le determinó al instante el pH (Combo, HANNA instruments® Inc., Woonsocket, RI), posteriormente se centrifugó a 3,500 x g a 4 ºC por 10 min.
Producción y perfil de AGV
Se colectó una submuestra de 8 mL en viales color ámbar rotulados, adicionándole 0.2 mL de H2SO4 al 50 % y se almacenaron a -20 ºC. Previo a su medición se descongelaron a 4 ºC, agregándole 1.6 mL de ácido metafosfórico al 25 %, centrifugándose nuevamente con las características arriba mencionadas y fueron preservadas en refrigeración (4 ºC) hasta realizar su análisis mediante la técnica de Brotz y Schaeffer (1987).
Los AGV fueron analizados por medio de un cromatógrafo de gases (SRI 8610, SRI Instruments, CA), con una columna Alltech ECONO-CAPTM ECTM de 15 m de largo, un diámetro externo de 0.53 mm y 0.25 mm de diámetro interno. Se inyectó 0.6 μL a temperatura del inyector de 230 ºC y detector de flama de 250 ºC, la rampa de temperatura del horno fue de 100 ºC, 20 ºC por min y 190 ºC por 1 min, un tiempo promedio de lectura de 1.51, 1.92 y 2.48 min para los ácidos ácético, propiónico y butírico, y un tiempo de lectura neta de 6.83 min.
N-NH3
Para esta variable se depositó una submuestra de 5 mL de sobrenadante en recipientes de plástico, para evaluarla mediante el espectrofotómetro Coleman Junior® II modelo 6|20 a una longitud de onda de 630 nanómetros (nm), siguiendo la técnica de Broderick y Kang (1980). La ecuación de predicción para calcular N-NH3, se obtuvo del análisis por triplicado de soluciones estándar con niveles de 0, 5, 10, 15, 20 y 25 μL de N-NH3/mL, utilizando agua destilada como blanco en el punto cero.
Ác. Láctico
Para su medición se colectó una submuestra de 5 mL en recipientes de plástico, para analizarla mediante el espectrofotómetro Coleman Junior® II modelo 6|20 a una longitud de onda de 570 nm, siguiendo la técnica de Taylor (1996). Al realizar la ecuación de predicción arriba mencionada, se utilizó Ác Láctico.
Análisis estadístico
Se utilizó un diseño completamente al azar para analizar la digestibilidad de MS, FDN, FDA y LDA, tomando como efecto fijo el tratamiento, así mismo, para las variables de Ác. Acético, Ác. Propiónico, Ác. Butírico, N-NH3, Ác. Láctico y pH se tomó como efecto fijo el tratamiento y hora, utilizando PROC GLM (SAS, 2006). Por otro lado, la PG se analizó de la misma forma tomando como efecto fijo el tratamiento y hora, así como su interacción. Se usó la prueba de Tukey para establecer las posibles diferencias entre las medias de los tratamientos (Steel y Torrie, 1997) y se declaró significancia estadística si p<0.05.
Las cantidades de PG acumulada in vitro se ajustaron al modelo no lineal monofásico de Groot et al., (1996), calculando los parámetros de fermentación A, B y C; con el procedimiento NLIN del SAS 9.3 (SAS, 2006).
G = A / (1 + (B / t)c )
Dónde: G.- Media de la producción de gas (mL 0.2 g de MS) para un tiempo de incubación dado; A.- Asíntota de producción de gas (mL 0.2 g de MS); B.- Tiempo (h) después de la incubación en la cual la mitad de la producción de gas ha sido alcanzada; C.- Constante que determina la forma y las características del perfil de la curva y, por lo tanto, la posición del punto de inflexión y t.- Variable predictora que representa el tiempo de incubación en horas.
Resultados y Discusión
Digestibilidad de la materia seca
La tabla 2 muestra que el T1 y T2 (72.02 y 72.49 %) fueron superiores (p<0.05) al T0 (64.57 %). Sauvant et al., (2004) observaron una tendencia a incrementar la digestibilidad de la MO (0.5 %) en vacas Holstein en el periodo seco que recibieron un CL en su dieta con respecto al grupo control. Por otra parte, Fadel El-seed et al., (2004) publicaron que la suplementación con Saccharomyces cerevisiae (Sc) con 0, 2.5 y 5 g d-1 en cabritos de la raza Nubia, incrementaron la digestibilidad de la MO en su dieta por 12.1 y 10.1 % y la digestibilidad de la FDN por 13.3 y 10.5 % para 2.5 y 5 g d-1 con respecto a la dieta control.
En este estudio no se observó diferencia (p>0.05) entre el T1 y T2, pero fueron superiores (p<0.05) al T0, esta respuesta ha sido asociada al incremento en la digestibilidad FDN, FDA y menor contenido de LDA en ambos tratamientos, lo que sugiere que el BMZN e IL mejoran por igual las características nutricionales de la dieta beneficiando el ambiente microbial. Lo que coincide con Chaucheyras-Durand y Fonty (2001) quienes mencionaron que la adición de Sc en la dieta de borregos en crecimiento estimuló el desarrollo de la flora celulolítica favoreciendo el funcionamiento del rumen. Tang et al., (2008) estudiaron el efecto de CL sobre las características de fermentación in vitro de rastrojo de arroz, trigo y de maíz, y reportaron que la dosis de 0, 2.5 y 7.5 g kg-1 de MS incrementaron la digestibilidad de MS in vitro para cada tipo de rastrojo. Sin embargo, Kawas et al., (2007) revelaron que la adición de CL en la dieta de corderos en finalización, no mostraron efecto sobre la digestibilidad de MS y FDN. También se ha mencionado que las levaduras consumen el oxígeno disponible en la superficie de la ingesta fresca de alimento para mantener la actividad metabólica y así reducir el potencial redox en el rumen (Chaucheyras-Durand et al., 2008).
Digestibilidad de la FDN y FDA
La mayor (p<0.05) digestibilidad de FDN lo presentó el T1 y T2 (70.77 y 70.25 %) con respecto al T0 (67.32 %). Estos mismo, fueron superiores (p<0.05) en la digestibilidad de FDA (T1 64.07 y T2 64.56 %) al compararse con el T0 (60.53 %; Tabla 2). Kholif y Khorshed (2006) reportaron un efecto positivo en la suplementación con levadura sobre la digestibilidad de la FDN, FDA, celulosa, hemicelulosa y PC. Así mismo, Wohlt et al., (1998) mencionaron que la digestibilidad de PC y FDA fue altamente significativa con la adición de CL de 10 y 20 g d-1 en vacas frescas alimentadas con una dieta basal de ensilaje de maíz, la digestibilidad de PC con 0, 10 y 20 g d-1presentaron 78.5, 80.8 y 79.5 % y la digestibilidad de la FDA con 0, 10 y 20 g d-1 mostraron 54.4, 60.2 y 56.8 %, respectivamente.
En el presente estudio, el T1 y T2 incrementaron (p<0.05) la digestibilidad de la FDN y FDA al compararse con el T0. Esto tal vez se debió a que mejoraron las características nutricionales de la dieta favoreciendo el ambiente microbial, lo que provocó un aumento de pH y N-NH3, disminuyendo el Ác. Láctico provocando un incremento en la degradación de la fibra. Lo que coincide con Chaucheyras-Durand et al., (2008) quienes reportaron que los CL mejoran el ambiente microbial del rumen, incrementando el número de bacterias que metabolizan lactato y por ende estabilizan el pH, así mismo, incrementan la degradación de la fibra beneficiando a los microorganismos que degradan la pared celular de las plantas. Koul et al., (1998) observaron un incremento en el número total de bacterias celulolíticas y proteolíticas cuando se adicionó un CL a vacas Holstein no lactantes. Sin embargo, la respuesta de CL no siempre son consistentes (Arcos-García et al., 2000), y algunas de las posibles causas podrían estar asociadas con las características de las diferentes cepas, la cantidad adicionada (Mendoza et al., 1995), tipo de animales y composición de la dieta (Wallace, 1994).
Digestibilidad de la LDA
El mayor contenido (p<0.05) de LDA lo reveló el T0 (5.55 %) con respecto al T1 y T2 (4.25 y 4.14 %). Lo que sugiere que el BMZN e IL mejoran las características nutricionales de la dieta (Tabla 2). La lignina es el componente principal de la estructura de la pared celular de las plantas, incrementando a través de la madurez (Guo et al., 2001), lo que afecta la digestibilidad del tejido vegetal (Van Soest, 1994), ya que generalmente se encuentra adherida a los carbohidratos estructurales de las paredes celulares proporcionando soporte a la planta (Whetten y Sederoff, 1995), lo cual está correlacionado negativamente con la calidad y digestibilidad del forraje por los rumiantes (Sewalt et al., 1996).
Producción de gas in vitro
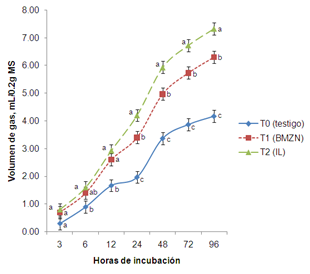
A las 12 h de incubación el T1 y T2 fueron similares entre sí (p>0.05) pero superiores al T0 (2.6, 2.9 y 1.7 mL/0.2 g de MS). Sin embargo, a las 24 h el T2 fue mayor (p<0.05) al T1 y T0 observándose un volumen de gas de 4.20, 3.40 y 1.97 mL/0.2 g de MS (Figura 1). Siguiendo la misma tendencia hasta las 96 h. La importancia de esta variable establece, que los alimentos con una alta producción de gas durante las primeras horas de fermentación incrementan el consumo voluntario, resultado de una alta tasa de digestión (Fadel El-seed et al., 2004). El volumen de gas producido durante las primeras 24 h de incubación dependerá de la composición química del substrato (PC, FDN, FDA y almidón).
La degradación de un substrato iniciará con las fracciones fácilmente digestibles, por lo cual, el comportamiento observado en este experimento puede ser explicado por la mayor digestibilidad de MS, FDN, FDA y menor contenido de LDA en los tratamientos que se le adicionó BMZN e IL, por lo que podemos asumir que favorecieron las características nutricionales de la dieta.

Figura 1. Producción de gas por tratamiento durante la fermentación ruminal in vitro. abcMedias con diferente literal en hora, son diferentes (p<0.05) entre tratamiento.
Parámetros de la fermentación in vitro
La Tabla 3 presenta los parámetros de la cinética de fermentación, donde el parámetro (a) representa la asíntota de PG (mL 0.2 g de MS), siendo el T1 y T2 (9.11 y 9.45 mL) quienes obtuvieron mayor (p<0.05) volumen de PG al compararse con el T0 (6.27 mL). Lo anterior expresa que el BMZN e IL mejoraron la digestibilidad de la fibra provocando un incremento en la tasa de fermentación y por ende un aumento en el volumen acumulado de PG.
Tabla 3.
Medias de los parámetros de la cinética de fermentación de
la MS de los tratamientos
Parámetro |
Tratamiento |
EE(±)1 |
||
T0 |
T1 |
T2 |
||
a |
6.27b |
9.11a |
9.45a |
0.32 |
b |
45.03a |
39.9a |
29.13a |
4.48 |
c |
0.94a |
0.89a |
1.02a |
0.04 |
abMedias con diferente literal en fila, son diferentes (p<0.05) entre tratamientos.
1EE= Error estándar de la media.
a
=Asíntota de producción de gas (mL 0.2 g de
MS).
b
=Tiempo (h) al cual se alcanza la mitad de la producción asintótica.
c=Tasa
de producción de gas (mL h).
El parámetro (b) expresa el tiempo (h) requerido para alcanzar la mitad asintótica de PG, donde al comparar las dietas con BMZN e IL con el testigo, no se determino diferencia (p>0.05) entre ellos. El T1 y T2 presentaron el menor tiempo (39.9 y 29.13 h), pero no variaron (p>0.05) con respecto al T0 (45.03 h). Williams et al., (1991) sugirieron que los microorganismos del rumen pueden ser estimulados por las levaduras al inicio de la fermentación, pero estos efectos serian insignificantes en mediano plazo con fermentaciones de larga duración. La función biológica de este parámetro señala que las dietas con BMZN y el IL requerirán 5.13 y 15.90 h menos de fermentación en rumen comparados con el testigo para alcanzar la mitad de la asíntota en PG.
El parámetro (c), indica la tasa de producción de gas (mL h), donde se puede observar que no hubo diferencia (p>0.05) entre tratamientos. Sin embargo, el T2 mostró mayor tasa de PG (1.02 mL h) sin presentar significancia (p>0.05) con respecto al T0 y T1 (0.94 y 0.89 mL h). Este comportamiento sugiere que el T1 y T2 tiene mayor velocidad de fermentación que el T0, pero sin mostrar cambios (p>0.05) en los parámetro b, c.
Producción y perfil de AGV
El T1 y T2 mostraron mayor (p<0.05) producción de Ác. acético (16.00 y 17.19 mmol L-1), Ác. propiónico (6.54 y 6.13 mmol L-1) y Ác. butírico (2.63 y 2.67 mmol L-1) con respecto al T0 (12.06, 3.52 y 1.21 mmol L-1 ) (Tabla 4).
Tabla 4.
Medias del comportamiento en la producción y perfil de
AGV entre tratamientos durante la fermentación in vitro
Variable |
Tratamientos |
EE(±)1 |
||
T0 |
T1 |
T2 |
||
Ác. Acético (mmol L-1) |
12.06b |
16.00a |
17.19a |
0.90 |
Ác. Propiónico (mmol L-1) |
3.52b |
6.54a |
6.13a |
0.75 |
Ác. Butírico (mmol L-1) |
1.21b |
2.63a |
2.67a |
0.41 |
ab Medias con diferente literal en fila, son diferentes (p<0.05) entre tratamiento.
1EE = Error estándar de la media.
Guedes et al., (2008) mencionaron que los CL mejoran la digestibilidad del alimento y los patrones de producción de AGV. Otros reportes indicaron que los CL no crecen en el rumen pero muestran cierto grado de viabilidad e influencian el curso de la fermentación ruminal a través de interacciones con los microorganismos del rumen (Wallace y Newbold, 1993). La adición de CL en dietas altas en fibra tiene efecto sobre la composición y producción de AGV, presentando un ligero incremento al adicionar productos de CL inactivas, por otro lado, al administrar CL vivas muestran una gran respuesta significativa (Opsi et al., 2012). Estos mismos autores mencionaron que al incrementarse la relación acetato:propionato en respuesta a la adición de CL, aumenta el acetato a expensas del propionato lo que indica una buena digestión de la fibra.
En este estudio, se observó un incremento (p<0.05) en la producción de los ácidos Acético, Propionico y Butírico en los tratamientos que se adicionó BMZN y un IL, esto tal vez debido a que mejoraron las características nutricionales de la dieta provocando una mayor digestibilidad de la MS, FDN, FDA y una disminución en el contenido de LDA. Por otro lado, la formación de Acetato es por la fermentación de carbohidratos estructurales por bacterias celulolíticas, mientras la fermentación de carbohidratos no estructurales es por bacterias amilolíticas lo que conduce a una producción de propionato. La adición de CL en la alimentación de rumiantes, ha mostrado efectos contradictorios sobre la producción de AGV en rumen. Corona et al., (1999) reportaron que novillos y corderos suplementados con 7.5 y 3 g d-1 de Sc, mostraron baja producción total de AGV y en la proporción molar de ácido butírico, respectivamente. Por otro lado, publicaron que la producción total de AGV en rumen y la proporción de Ác. acético, propiónico y butírico no fueron afectados por la adición de CL (Pinos-Rodríguez et al., 2008).
Nitrógeno amoniacal (N-NH3)
El N-NH3 presentó significancia (p<0.05) por efecto de interacción tratamiento*hora. El T1 y T2 (0.18, 0.22, 0.23 y 0.18, 0.20, 0.24 mmol L-1) fueron similares entre sí (p>0.05) pero superiores (p<0.05) al T0 (0.14, 0.17, 0.18 mmol L-1) a las 6, 12 y 48 h de incubación.
Por otra parte, el T1 (0.26 mmol L-1) fue superior (p<0.05) al T0 y T2 (0.17 y 0.22 mmol L-1) a las 24 h, siendo este último mayor (p<0.05) al T0. Sin embargo, a las 72 y 96 h el T2 (0.25, 0.27 mmol L-1) mostró mayor (p<0.05) concentración de N-NH3 al compararse con el T0 y T1 (0.20, 0.21 y 0.23, 0.22 mmol L-1) siendo este último superior (p<0.05) al T0 (Figura 2). La concentración de amonio puede estar influenciada por la tasa de degradación de los carbohidratos, además de los componentes nitrogenados (Bernal et al., 2008). Así mismo, Getachew et al., (2000) mencionaron que al aumentar la degradación de carbohidratos la concentración de amonio se verá afectada por que promueve el crecimiento microbial que se refleja en pérdidas de N-NH3.
En este estudio, se observó un incremento (p<0.05) en la concentración de N-NH3 en las dietas que se adicionó BMZN y un IL, esto tal vez debido a que mejoraron las características fermentativas de la dieta y por consiguiente incrementaron la digestibilidad de la fibra, lo que coincide con Newbold et al., (1995) quienes observaron un aumento en la concentración de N-NH3 en la fermentación ruminal in vitro, lo que atribuye mayor disponibilidad de substrato para los microorganismo. Por otra parte, la concentración de N-NH3 no mostro cambios al adicionar CL vivas o inactivas en dietas altas en concentrado, lo que coincide con Guedes et al., (2008) utilizando diferentes substratos en su experimento, sin embargo, la adición de CL en dietas altas en fibra incrementó la concentración de amoniaco.
El pH bajo inhibe la producción de N-NH3 in vitro porque afecta a las bacterias metanogénicas (Methanobacterium bryantii, M. formicicum y Methanosarcina barkeri) y protozoarios en la degradación de la fibra (Nagaraja y Titgemeyer, 2007).
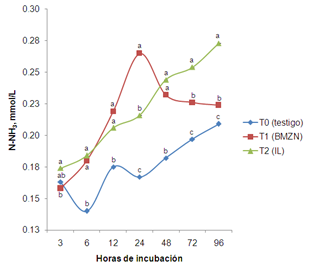
Figura 2. Comportamiento de N-NH3 durante 96 horas de incubación in vitro. abcMedias con difrente literal en hora, son diferentes (p<0.05) entre tratamiento.
Ác. Láctico y pH
El T0 (3.38, 4.82, 3.63, 2.16 mmol L-1) mostró mayor (p<0.05) concentración de Ác. Láctico al compararse con el T1 y T2 (0.80, 1.99, 0.99, 0.84 y 1.69, 1.43, 0.80, 0.56 mmol L-1) a las 3, 6, 12 y 24 h de incubación. Sin embargo, los tres tratamientos fueron similares (p>0.05) a las 48, 72 y 96 h (Figura 3).
El pH más alto (p<0.05) lo presentó el T2 al compararse con el T0 y T1 durante las 96 h de incubación, excepto a las 12 y 24 donde el T2 fue similar (p>0.05) al T1. El T0 presentó el descenso más pronunciado (p<0.05) de pH durante el tiempo de incubación al compararse con el T1 y T2 respectivamente (Figura 4).
El pH ruminal refuerza el balance entre la capacidad amortiguadora y la acidez de la fermentación. De un meta análisis Desnoyers et al., (2009) reportaron un incremento de pH y la concentración total de AGV en rumen, en relación a la suplementación y dosis de SC. Marden et al., (2008) mencionaron que el pH incrementó cuando adicionaron en el alimento 5 g/animal/día de células de levaduras vivas (1 x 1010 CFC g-1 de SC). En otro estudio, observaron que cuando el ensilaje de maíz fue fermentado, el efecto de CL sobre el pH fue consistente con los cambios mostrados en la concentración de lactato ruminal. La creciente actividad de las bacterias que utilizan lactato o la disminución de la actividad para producirlo, puede causar una baja concentración dando lugar a valores altos de pH en el rumen (Guedes et al., 2008). Lila et al., (2004) reportaron una disminución en la concentración de lactato en respuesta a la adición de CL en la fermentación de concentrados y forrajes. Sin embargo, Opsi et al., (2012) mencionaron que la concentración de lactato incrementó al añadir CL en dietas altas en concentrado, lo cual coincide con resultados publicados por Lynch y Martin (2002) al utilizar grano de maíz molido como substrato de fermentación.
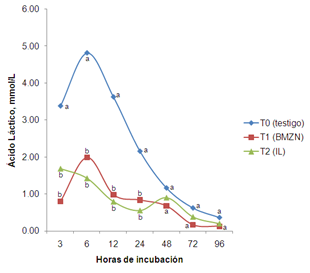
Figura 3. Comportamiento de Ac. Láctico durante 96 horas de incubación in vitro. abcMedias con diferente literal en hora, son diferentes (p<0.05) entre tratamiento
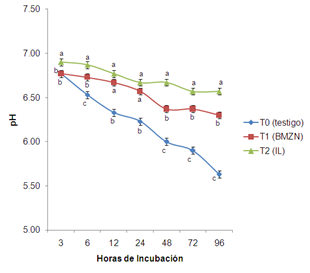
Figura 4. Comportamiento de pH durante 96 horas de incubación in vitro. abcMedias con diferente literal en hora, son diferentes (p<0.05) entre tratamiento.
En este estudio, se observó que el T1 y T2 disminuyeron (p<0.05) la concentración de Ác. Láctico más pronunciado que el T0, mientras que ambos fueron mejores en incrementar (p<0.05) el pH con respecto a este último, esto tal vez se debió a que mejoraron las características fermentativas favoreciendo a las bacterias que consumen lactato (Megasphaera elsdenii y Selenomonas ruminantium) manteniendo un pH óptimo, lo que coincide con Robinson (2012), quien observó que la modulación del pH del rumen es uno de los efectos de la adición de levaduras en la dieta, ejerciendo un incremento promedio del pH (1.6%), un incremento global del total de AGV (5.4 %) y una disminución general en la concentración de lactato (8.1 %).
Conclusiones
Se concluye que la adición de un inóculo de levaduras y de bagazo de manzana fermentado en la dieta de becerros en crecimiento, mejoran las características nutricionales y fermentativas de la dieta, lo que representa una alternativa en la suplementación animal. Se recomienda desarrollar más investigación con diferentes niveles de inclusión de estos suplementos, con el fin de alcanzar mayor digestibilidad de la fibra.
Literatura citada
AOAC. Official methods of analysis. 16 th edition. Washington DC: Association of Official Analytical Chemists. 2000.
Arcos-García JL, Castrejón FA, Mendoza GD, Pérez-Gavilán EP. Effect of two commercial yeast cultures with Saccharomyces cerevisiae on ruminal fermentation and digestion in sheep fed sugar cane tops. Livestock Production Science 2000; 63: 153-157.
Beauchemin KA, Colombatto D, Morgavi DP, Yang WZ. Use of exogenous fibrolytic enzymes to improve feed utilization by ruminants. Journal of Animal Science 2003; 81: 37-47.
Bernal L, Ávila P, Ramírez G, Lascano CE, Tiemann T, Hess H. Efecto del ensilaje y el heno de Calliandra calothyrsus, Flemingia macrophylla, Cratylia argéntea y Vigna unguiculata sobre la producción de gas in vitro. Archivos Latinoamericanos de Producción Animal 2008; 3: 101-107.
Broderick GA, Kang JH. Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media. Journal of Dairy Science 1980; 63: 64-75.
Brotz PG, Schaeffer DM. Simultaneous determination of lactic acid and volatile fatty acids in microbial fermentation extracts by gas-liquid chromatography. Journal of Microbiological Methods 1987; 6: 139-144.
Bruni MA, Chilibroste P. Simulation of ruminal digestion by gas production method. Archivos Latinoamericanos de Producción Animal 2001; 9: 43-51.
Chaucheyras-Durand F, Fonty G. Establishment of cellulolytic bacteria and development of fermentative activities in the rumen of gnotobiotically-reared lambs receiving the microbial additive Saccharomyces cerevisiae CNCM I-1077. Reproduction Nutrition Development 2001; 41: 57-68.
Chaucheyras-Durand F, Walker ND, Bach A. Effects of active dry yeasts on the rumen microbial ecosystem: past, present and future. Animal Feed Science Technology 2008; 145: 5-26.
Corona L, Mendoza GD, Castrejon FA, Crosby MM, Cobos MA. Evaluation of two yeast cultures (Saccharomyces cerevisiae) on ruminal fermentation and digestion in sheep fed a corn stover diet. Small Ruminant Research 1999; 31: 209-214.
Desnoyers M, Giger-Reverdin S, Bertin G, Duvax-ponter C, Sauvant D. Meta-analysis of the influence of Saccharomyces cerevisiae supplementation on ruminal parameters and milk production of ruminants. Journal of Dairy Science 2009; 92: 1620-1632.
Fadel El-seed ANMA, Sekine J, Kamel HEM, Hishinuma M. Changes with time after feeding in ruminal pool sizes of cellular contents, crude protein, cellulose, hemicellulose and lignin. The Indian Journal of Animal Science 2004; 74: 205-210.
Getachew G, Makkar HPS, Becker K. Effect of polyethylene glycol on in vitro degradability of nitrogen and microbial protein synthesis from tannin-rich browse and herbaceous legumes. British Journal of Nutrition 2000; 84: 77-83.
Goering HK, Van Soest PJ. Forage fiber analyses (Apparatus, Reagents, Procedures and some Applications). Agriculture, Handbook.USDA-ARS, Washington, DC. 1970. 379.
Groot JCJ, Cone JW, Williams BA, Debersaques FMA, Lantinga EA. Multiphasic analysis of gas production kinetics for in vitro fermentation of ruminant feeds. Animal Feed Science and Technology 1996; 64: 77-89.
Guedes CM, Goncalves D, Rodríguez MAM, Días-DaSilva A. Effects of Saccharomyces cerevisiae yeasts on ruminal fermentation and fiber degradation of maize silages in cows. Animal Feed Science and Technology 2008; 145: 27-40.
Guo D, Chen F, Inoue K, Blount JW, Dixon RA. Downregulation of ceffeic acid 3-O-methyltranferase and caffeoyl CoA 3-O-methyltranferase in transgenetic alfalfa: Impacts on lignin structure and implications for the biosynthesis of G and S lignin. Plant Cell 2001; 13: 73-88.
Haddad SG, Goussous SN. Effect of yeast culture supplementation on nutrient intake, digestibility and growth performance of Awassi lambs. Animal Feed Science and Technology 2005; 118: 343-348.
Kawas JR, Carcia-Castillo R, Garza-Cazares F, Fimbre-Durazo H, Olivares-Saenz E, Hernandez-Vidal G, et al., Effects of sodium bicarbonate and yeast on productive performance and carcass characteristics of light-weight lambs fed finishing diets. Small Ruminant Research 2007; 67: 157-163.
Kholif SM, Khorshed MM. Effect of yeast or selenized yeast supplementation to rations on the productive performance of lactating buffaloes. Egyptian Journal of Nutrition and Feeds 2006; 9: 193-205.
Koul V, Kumar U, Sareen VK, Singh S. Mode of action of yeast culture (Yea-Sacc1026) for stimulation of rumen fermentation in buffalo calves. Journal of the Science of Food and Agriculture 1998; 77: 407-413.
Lesmeister KE, Heinrichs AJ, Gabler MT. Effects of supplemental yeast (Saccharomyces cerevisiae) culture on rumen development, growth characteristics, and blood parameters in neonatal dairy calves. Journal of Dairy Science 2004; 87: 1832–39.
Lila ZA, Mohammed N, Yasui T, Kurokawa Y, Kanda S, Itabashi H. Effects of a twin strain of Saccharomyces cerevisiae live cells on mixed ruminal microorganism fermentation in vitro. Journal of Animal Science 2004; 82: 1847-54.
Lynch HA, Martin SA. Effects of Saccharomyces cerevisiae culture and Saccharomyces cerevisiae live cells on in vitro mixed ruminal microorganism fermentation. Journal of Dairy Science 2002; 85: 2603-08.
Marden JP, Julien C, Monteils V, Auclair E, Moncoulon R, Bayourthe C. How does live yeast differ from sodium bicarbonate to stabilize ruminal pH in high-yielding dairy cows?. Journal of Dairy Science 2008; 91: 3528-35.
Mendoza MGD, Ricalde VR, Esparza BH, Velazquez TL. Technical note: effects of two yeast cultura with Saccharomyces cerevisiae on ruminal neutral detergent fiber degradability. Investigación Agraria: Producción y Sanidad Animal 1995; 10: 33-38.
Menke KH, Steingass H. Estimation of the energetic feed value obtained from chemical analysis and in vitro gas production using rumen fluid. Animal Research and Development 1988; 28: 7-55.
Muro RA. Cinética de degradación ruminal de tres fuentes de forraje mediante la técnica de digestibilidad in vitro por producción de gas (tesis de doctorado). Chihuahua: Universidad Autónoma de Chihuahua, 2007.
Nagaraja TG, Titgemeyer EC. Ruminal acidosis in beef cattle: the current microbiological and nutritional outlook. Journal of Dairy Science 2007; 90: 17-38.
Newbold CJ, Wallace RJ, Chen XB, Mcintosh FM. Different strains of Saccharomyces cerevisiae differ in their effects on ruminal bacterial numbers in vitro and in sheep. Journal of Animal Science 1995; 73: 1811-18.
NRC. Nutrient requirements of beef cattle. 7th edición. Washington: National academy press, 1996. 104.
Opsi F, Fortina R, Tassone S, Bodas R, López S. Effects of inactivated and live cells of Saccharomyces cerevisiae on in vitro ruminal fermentation of diets with different forage:concentrate ratio. Journal of Agricultural Science 2012; 150: 271-283.
Pinos-Rodríguez JM, Robinson PH, Ortega ME, Berry SL, Mendozad G, Barcena R. Performance and rumen fermentation of dairy calves supplemented with Saccharomyces cerevisiae 1077 or Saccharomyces boulardii 1079. Animal Feed Science and Technology 2008; 140: 223-232.
Robinson PH. Yeast products for growing and lactating ruminants: A literature summary of impacts on rumen fermentation and performance. [serie en internet] 2012 [consultado 2012 diciembre 10]; [aprox. 13 pp] Disponible en: http://animalscience.ucdavis.edu/faculty/robinson/Articles/FullText/pdf/Web200901.pdf.
SAS. SAS/STAT® 9.3 User´s Guide. Statistic, edition. SAS Institute Inc, United States. 2006.
Sauvant D, Giger-Reverdin S, Schmidely P. Rumen acidosis: Modeling ruminant. Proceeding of the Alltech´s 20th annual symposium: Re-imagining the feed industry. Nottingham University Press, 2004: 221-229.
Sewalt VJH, Glasser WG, Fontenot JP, Allen VG. Lignin impact on fiber degradation. 1 quinonemethide intermediates formed from lignin during in vitro fermentation of corn stover. Journal of the Science of Food and Agriculture 1996; 71:195-203.
Steel RGD, Torrie JH. Bioestadística. Principios y procedimientos. 2a. edición. México: McGraw-Hill. 1997.
Tang SX, Tayo GO, Tan ZL, Sun ZH, Shen LX. Effects of yeast culture and fibrolytic enzyme supplementation on in vitro fermentation characteristics of low quality cereal straws. Journal of Animal Science 2008; 86:1164-72.
Taylor KACC. A simple colorimetric assay for muramic acid and lactic acid. Applied Biochemistry and Biotechnology 1996; 56: 49-58.
Theodorou MK, Williams BA, Dhanoa MS, McAllan AB, France J. A simple gas production method using a pressure transducer to determine the fermentation kinetics of ruminant feeds. Animal Feed Science and Technology 1994; 48:185-197.
Van Soest PJ, Robertson JB, Lewis BA. Methods for dietary fiber, neutral detergent fiber, and non-starch polysaccharides in relation to animal nutrition. Journal of Dairy Science 1991; 74: 3579-83.
Van Soest PJ. Nutritional ecology of the ruminant. 2a edition. United States. Cornell University Press.Ithaca, N.Y. 1994. 475.
Wallace RJ, Newbold CJ. Rumen fermentation and its manipulation: the development of yeast culture as feed additives. In: TP, Lyons edition. Biotechnology in the feed industry. Alltech technical publications. United States. 1993. 173.
Wallace RJ. Ruminal microbiology, biotechnology and ruminant nutrition: progress and problems. Journal of Animal Science 1994; 72: 2992-3003.
Whetten R, Sederoff R. Lignin biosynthesis. The plant cell 1995; 7:1001-13.
Williams PE, Tait CA, Innes GM, Newbold CJ. Effects of the inclusion of yeast culture (Saccharomyces cerevisiae plus growth medium) in the diet of dairy cows on milk yield and forage degradation and fermentations patterns in the rumen of steers. Journal of Animal Science 1991; 69: 3016-26.
Wohlt JE, Corcione TT, Zajac PK. Effect of yeast on feed intake and performance of cows fed diets based on corn silage during early lactation. Journal of Dairy Science 1998; 81: 1345-52.